Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
Механизм важнейшей окислительной реакции Байера–Виллигера, известной больше ста лет, раскрыт международной группой ученых. Реакция является универсальным путем получения эфиров органических кислот – базовых соединений для химической промышленности. Результаты исследования позволят предложить новые промышленные процессы окисления и классы антипаразитарных органических пероксидов для лечения малярии и гельминтозов. Работа выполнена при поддержке гранта Российского научного фонда (РНФ) и опубликована в журнале Angewandte Chemie International Edition. Кратко о результатах рассказывает пресс-релиз РНФ.
 © Pixabay
© Pixabay
Реакция Байера–Виллигера была открыта в 1899 году немецкими химиками Адольфом фон Байером и Виктором Виллигером. Ее суть заключается в окислении необходимых в промышленности веществ — кетонов и альдегидов — до сложных эфиров (производных органических кислот с замещением водорода СООН-группы на углеводородную цепь) под действием пероксокислот. Последние представляют собой кислоты с группировкой из двух связанных атомов кислорода. Реакция нашла применение, например, при производстве капролактона — предшественника многих полимеров. Несмотря на это, механизм процесса до недавнего времени оставался загадкой и существовал лишь «на бумаге»: ученым никак не удавалось зафиксировать или выделить промежуточное соединение (интермедиат).
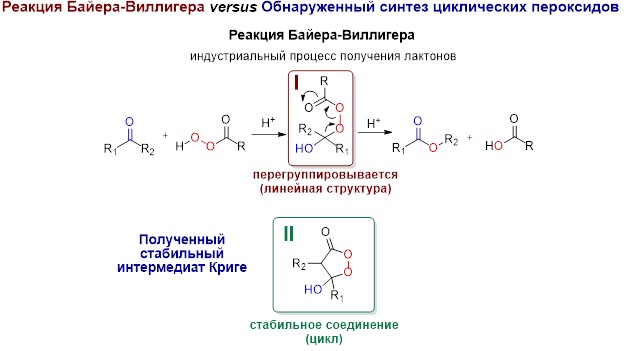 Реакция Байера–Виллигера versus
Реакция Байера–Виллигера versus
Обнаруженный синтез циклических пероксидов
© Александр Терентьев
«В середине прошлого столетия Рудольф Криге предложил вариант возможного промежуточного соединения. В нашем исследовании мы сконструировали ловушку для интермедиатов Криге, что позволило получить их в стабильном виде и охарактеризовать», — рассказывает Александр Терентьев, доктор химических наук, член-корреспондент РАН, заведующий лабораторией в Институте органической химии имени Н.Д. Зелинского РАН.
На первом этапе реакции пероксидный фрагмент пероксокислоты атакует молекулу кетона или альдегида. Целью становится углерод карбонильной (=С=O) группы, и в результате он оказывается заключен между двумя кислородами. Один является «его собственным», а другой приходит от пероксокислоты и пока остается с ним связанным. По бокам от карбонильного углерода находятся заместители кетона или альдегида, представленные углеводородными цепями. Так устроен реакционный центр интермедиата Криге, который впоследствии окажется в самой гуще событий и именно в нем произойдут ключевые перестройки, приводящие к образованию эфира.
Неустойчивость промежуточных соединений реакции Байера–Виллигера могут объяснить эффекты совместного влияния электронов, атомов и их пространственного расположения на реакционный центр. Например, в обычном промежуточном соединении создаются благоприятные условия для перехода одного из заместителей кетона или альдегида к атому кислорода пероксидного фрагмента пероксокислоты. Таким образом, происходит перестройка молекулы в конечный продукт: исходное соединение оказывается окислено. Авторам работы удалось стабилизировать промежуточное соединение Криге, нарушив эти эффекты взаимодействий благодаря созданию его замкнутой, циклической версии. Результаты исследования дают ключ к пониманию механизма реакции Байера–Виллигера, что позволит более результативно проводить ее оптимизацию и конструировать соединения, ускоряющие реакцию.
«Наши данные помогут увеличить избирательность и расширить номенклатуру в производстве мономеров – молекул-«кирпичиков» для построения полимера, а также позволят предложить новые промышленные процессы окисления и классы антипаразитарных органических пероксидов. Важно отметить, что в 2015 году за использование природного циклического пероксида артемизинина для лечения малярии была вручена Нобелевская премия по физиологии и медицине. Полученные на основе недорогих и доступных полупродуктов стабильные интермедиаты Криге представляют собой новый класс циклических органических пероксидов и в перспективе смогут применяться для лечения малярии и гельминтозов», — заключает Александр Терентьев.
Источник: polit.ru
| ( ! ) Warning: Invalid argument supplied for foreach() in /home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php on line 44 | ||||
|---|---|---|---|---|
| Call Stack | ||||
| # | Time | Memory | Function | Location |
| 1 | 0.0000 | 350280 | {main}( ) | .../index.php:0 |
| 2 | 0.0000 | 350560 | require( '/home/domains/malitikov.ru/public_html/wp-blog-header.php ) | .../index.php:17 |
| 3 | 0.5197 | 8489456 | require_once( '/home/domains/malitikov.ru/public_html/wp-includes/template-loader.php ) | .../wp-blog-header.php:19 |
| 4 | 0.5213 | 8513152 | include( '/home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php ) | .../template-loader.php:106 |