Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
Органоиды — биологические системы, выращенные in vitro и затем самоорганизующиеся в трехмерные клеточные ткани определенных органов. Органоиды мозга, в частности, стали ценными моделями для изучения развития главного органа центральной нервной системы. Однако обеспечение стабильного питания растущих структур остается одной из проблем в этой области, и исследователи нуждаются в улучшенных инструментах культивирования и визуализации, чтобы иметь возможность фиксировать динамику процессов развития мозга in vitro.
Ученые из Массачусетского технологического института в США и Индийского технологического института в Мадрасе за семь дней вырастили небольшие фрагменты самоорганизующейся мозговой ткани в крошечном и недорогом биореакторе, напечатанном на 3D-принтере. Описание разработки представлено в журнале Biomicrofluidics.
«Микрофлюидный биореактор» представляет собой чип размером четыре на шесть сантиметров и включает небольшие лунки, где растут органоиды. Каждый из них наполнен жидкостью, богатой питательными веществами, которая закачивается и выходит автоматически — как жидкости, проходящие через настоящий мозг. Устройства для выращивания органоидов этого органа уже существуют, но поскольку чашки закрыты во избежание заражения микроорганизмами из воздуха, туда невозможно добавлять питательные вещества (аминокислоты, витамины, соли и глюкозу) или удалять отходы, производимые клетками. В итоге те умирают за несколько дней. Кроме того, зачастую чашки для культивирования расположены на планшетах со стеклянными дном — а они дороги и совместимы только с определенными микроскопами.
Напечатанный на 3D-принтере микрожидкостный биореактор для выращивания различных клеточных культур / © Ikram Khan et al.
С недавних пор ученые начали использовать технику, известную как микрофлюидика или микрогидродинамика: питательная среда доставляется через маленькие трубки, подключенные к крошечной платформе или чипу. Но и такие микрофлюидные устройства, опять же, дороги и сложны в изготовлении, плюс из-за их непрозрачного дизайна невозможно наблюдать за происходящим внутри чашки — серьезная проблема, ведь ученые хотят знать, как ткань реагирует на вводимые препараты.
Авторы новой разработки решили использовать 3D-печать для создания многоразовой и легко регулируемой платформы, создание которой обойдется всего в пять долларов. Она включается в себя крошечные трубки, каналы для инъекций лекарств и даже отделение для подогрева жидкости на одном чипе, который можно напечатать на 3D-принтере с использованием биосовместимого типа смолы, применяемой в стоматологии. Биореакторы контролируют поток жидкости и отток отходов через трубки в закрытом инкубаторе, обеспечивая при этом полную видимость.
«Наши затраты были значительно ниже, чем у традиционных техник культивирования органоидов на основе чашки Петри или спинового биореактора, — рассказал один из авторов исследования Икрам Хан. — К тому же чип можно промывать дистиллированной водой, сушить и автоклавировать, а затем использовать повторно».
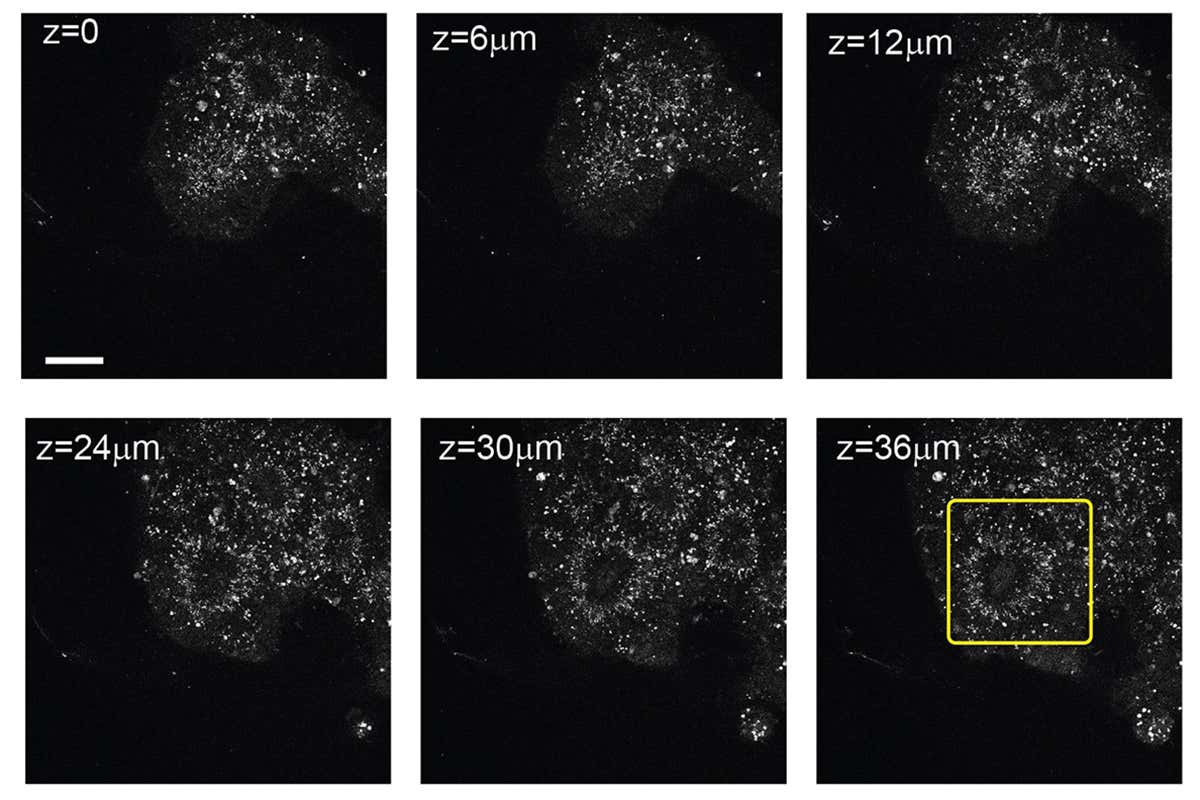
Чтобы проверить разработку, ученые поместили дифференцированные стволовые клетки мозга человека в лунки и запрограммировали поток жидкости через чип. Используя микроскоп над платформой, им удалось наблюдать за развитием мозговой ткани на протяжении недели, пока органоиды не заняли все пространство крошечных лунок. За это время клетки размножались и образовывали структуру, похожую на желудочек и полости, наблюдаемые в реальном мозге. Желудочек окружала ткань, которая выглядела как ткань неокортекса, отвечающего за функции высокого порядка: мышление, рассуждение и понимание речи.
Ранее выращенные органоиды мозга уже достигали аналогичного уровня развития в лабораториях, однако это первый случай, когда все произошло в устройстве, обеспечивающем такую хорошую видимость ткани и за столь малые деньги. Процент клеток в ядре органоида, погибших за неделю исследований, оказался меньше, нежели в обычных условиях культивирования. По мнению ученых, секрет в том, что их устройство защищает крошечный растущий мозг.
«Преимущество этого микрофлюидного устройства в том, что оно обеспечивает постоянную перфузию культуральной камеры, которая точнее имитирует физиологическую перфузию ткани, нежели обычная культура, и тем самым снижает риск гибели клеток в ядре органоида. <...> Наша цель — чтобы эта технология достигла людей во всем мире, которые в ней нуждаются», — подытожил Хан.
| ( ! ) Warning: Invalid argument supplied for foreach() in /home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php on line 44 | ||||
|---|---|---|---|---|
| Call Stack | ||||
| # | Time | Memory | Function | Location |
| 1 | 0.0000 | 350136 | {main}( ) | .../index.php:0 |
| 2 | 0.0000 | 350416 | require( '/home/domains/malitikov.ru/public_html/wp-blog-header.php ) | .../index.php:17 |
| 3 | 0.0941 | 8874072 | require_once( '/home/domains/malitikov.ru/public_html/wp-includes/template-loader.php ) | .../wp-blog-header.php:19 |
| 4 | 0.0958 | 8906264 | include( '/home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php ) | .../template-loader.php:125 |