Химики из Германии показали, как мог проходить синтез пептидов до возникновения жизни на Земле. Они выяснили, что на фрагментах транспортных РНК с неканоническими азотистыми основаниями, содержащими остатки аминокислот, могут получаться пептиды без участия рибосом.
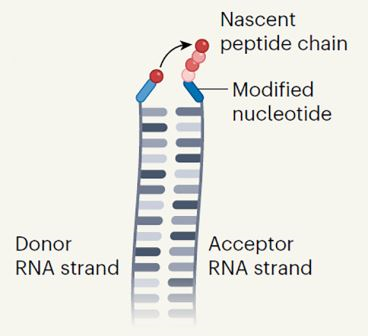
 Синтез полипептида на комплементарных цепях РНК без участия рибосомы.
Синтез полипептида на комплементарных цепях РНК без участия рибосомы.
Цепи содержат неканонические нуклеотиды.
© C. Bonfio / Nature, 2022
Молекулы РНК — хранители генетической информации в живых организмах. Они состоят из нуклеотидов, которые содержат азотистые основания — аденин (A), урацил (U), гуанин (G) и цитозин (C). На основе генетического кода, который хранят молекулы РНК, происходит биосинтез белков. При этом для биосинтеза необходима рибосома, именно с ее помощью образуются пептидные связи между аминокислотами, а в результате получается белок.
Так как за счет считывания информации с РНК происходит биосинтез белка, многие биологи считают, что молекулы РНК существовали до появления белков и катализировали синтез сложных органических молекул в пребиотических условиях (гипотеза мира РНК). Но как именно молекулы РНК могли ускорять синтез белков и пептидов, ученым до сих пор неизвестно.
Химики под руководством Томаса Карелла (Thomas Carell) из Мюнхенского университета Людвига и Максимилиана нашли один из возможных механизмов этого процесса. Им было известно, что в состав молекул транспортных РНК, помимо четырех основных азотистых оснований, могут входить несколько неканонических оснований. Причем некоторые из них содержат остатки аминокислот. Поэтому ученые предположили, что из этих аминокислотных остатков в пребиотических условиях могли получаться пептиды.
Чтобы проверить свою гипотезу, химики синтезировали два комплементарных набора цепей тРНК, содержащих неканонические азотистые основания. В одном из наборов неканонические нуклеотиды содержали фрагменты аминокислот со свободной карбоксильной группой, а в другом — свободную аминогруппу. Когда ученые смешали две комплементарные цепи тРНК из двух наборов в водном растворе, между ними образовались водородные связи, а фрагменты аминокислот стали ближе друг к другу.
Затем химики добавили в смесь карбодиимид — активатор карбоксильной группы — и между двумя аминокислотными фрагментами образовалась пептидная связь. В результате дальнейшего нагревания раствора при температуре 90 градусов Цельсия произошел гидролиз, а фрагмент аминокислоты оказался на комплементарной цепи тРНК. Таким образом ученые выяснили, что комплементарные РНК с неканоническими основаниями могут передавать друг другу аминокислотные фрагменты с образованием пептидов.
Когда химики попробовали провести эту же цепочку превращений несколько раз, им удалось получить полипептид. Но реакция работала не всегда, а только в случае, если исходные РНК содержали как минимум три нуклеотида и были комплементарны. Интересно, что в обычном биосинтезе белков на рибосомах каждую аминокислоту также кодируют три нуклеотида РНК.
В результате химики показали, что полипептидные цепочки могут образовываться при участии тРНК без рибосом. При этом синтез контролируется комплементарностью молекул тРНК, как и в случае обычного биосинтеза на рибосоме. Реакции образования пептидной связи протекали с выходом около 50 процентов, а выход реакции гидролиза в большинстве случаев не превышал 10 процентов: при нагревании до 90 градусов часть цепей тРНК разрушалась.
Статья опубликована в журнале Nature
Источник: Михаил Бойм nplus1.ru