Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
Ведутся технические работы. Это может временно повлиять на скорость работы сайта. Приносим извинения за неудобства и благодарим за ваше понимание!
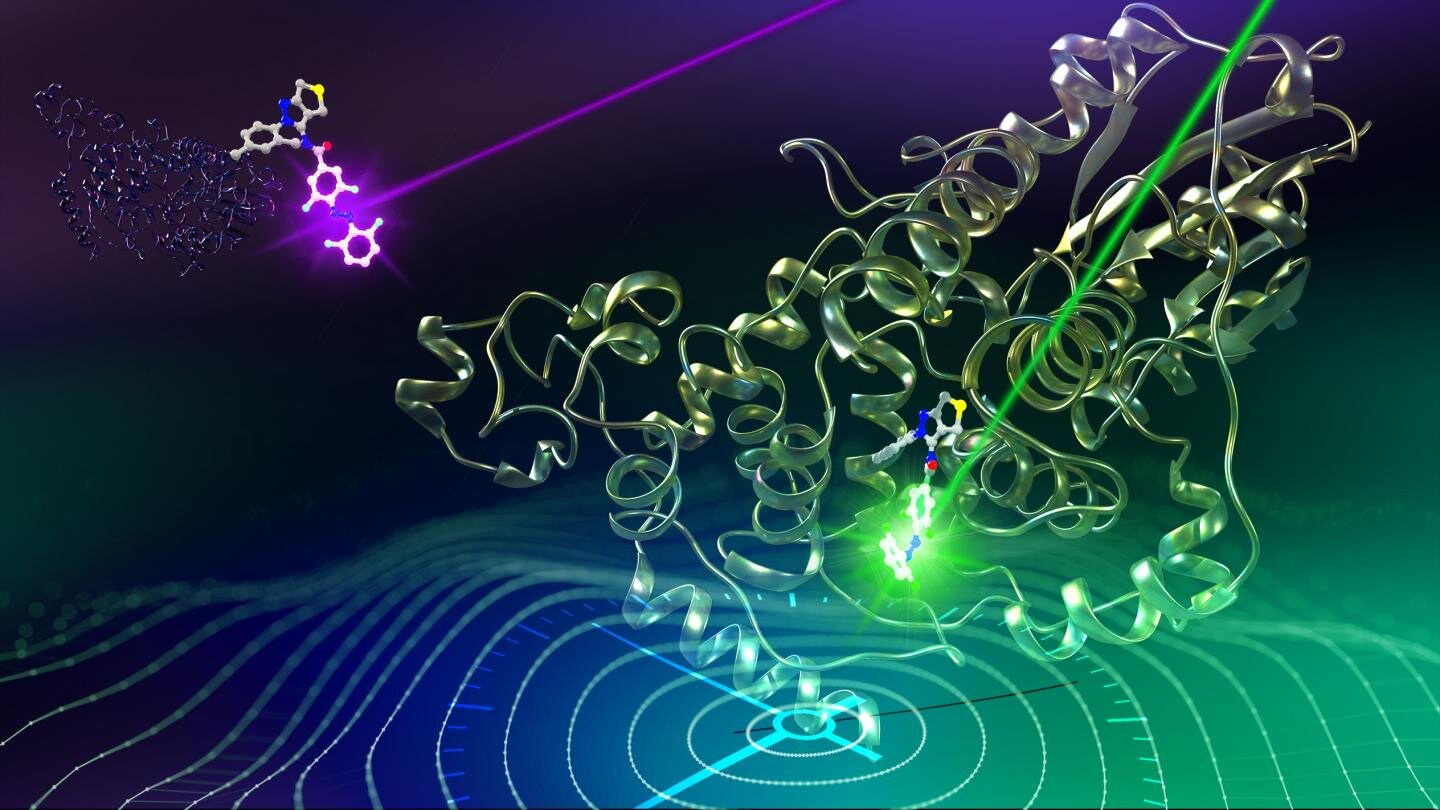
Международный коллектив ученых из Нагойского (Япония) и Гронингенского (Нидерланды) университетов опубликовал результаты своих экспериментов в рецензируемом журнале Journal of the American Chemical Society (JACS). Исследователи изучали внутриклеточные механизмы, отвечающие за циркадные ритмы. В частности, они искали способы, которыми специальные светочувствительные белки — криптохромы CRY1 и CRY2 — взаимодействуют с другими полипептидами в человеческих клетках.
С помощью рентгеноструктурного анализа экспериментаторы внимательно следили за реакциями внутри клетки, в которых участвуют криптохромы. Им удалось локализовать два отвечающих за удлинение циркадного ритма соединения — TH303 и TH129. Их интересной особенностью является наличие в составе дифенилкетона (benzophenone), который, в свою очередь, соединен с цис-изомером азобензола (azobenzene). Последний в своей транс-форме может выполнять роль чувствительного к свету химического датчика.
Исследователи создали новое соединение — GO1323 — аналог TH129, в котором дифенилкетон заменен на азобензол. Полученная молекула переходила из одной формы в другую под действием света разной длины волны. Когда ее облучали ультрафиолетом, она превращалась в цис-изомер, а когда помещали под белый свет — в транс-изомер. Более того, компьютерное моделирование показало, что GO1323 взаимодействует с CRY1 также, как и TH129.
В результате получалось, что если в клетку ввести такое соединение, то под действием ультрафиолета ее циркадные ритмы увеличатся. А при облучении обычным белым светом — вернутся в норму. Оставалась только одна проблема: ультрафиолет оказывает, в целом, не слишком благоприятный эффект на живые клетки. Решение нашлось в соединении со сложным названием тетраортофторазобензин (tetraorthofluoroazobenzine). Его интегрировали вместо дифенилкетона в новый аналог TH129 — GO1423.
Получившаяся молекула показала свою высокую эффективность при внедрении в живую культуру человеческих клеток. Их циркадные ритмы легко изменялись при помощи зеленого света (удлинялись) и фиолетового (возвращались в норму). Таким образом получилось создать обратимый способ модификации биологических часов на клеточном уровне.
Важно отметить, что результаты данного исследования еще очень далеки от реальной медицинской практики. Но они чрезвычайно важны для понимания того, какие биохимические механизмы отвечают за внутриклеточные биологические часы. Это позволит в дальнейшем создать эффективные методы лечения расстройств сна, метаболического синдрома и даже некоторых видов рака.
| ( ! ) Warning: Invalid argument supplied for foreach() in /home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php on line 44 | ||||
|---|---|---|---|---|
| Call Stack | ||||
| # | Time | Memory | Function | Location |
| 1 | 0.0000 | 350408 | {main}( ) | .../index.php:0 |
| 2 | 0.0000 | 350688 | require( '/home/domains/malitikov.ru/public_html/wp-blog-header.php ) | .../index.php:17 |
| 3 | 0.3136 | 8487768 | require_once( '/home/domains/malitikov.ru/public_html/wp-includes/template-loader.php ) | .../wp-blog-header.php:19 |
| 4 | 0.3162 | 8512072 | include( '/home/domains/malitikov.ru/public_html/wp-content/themes/malitikov/single.php ) | .../template-loader.php:106 |